深入解析如何唤醒免疫系统,让“冷”肿瘤无处遁形
免疫治疗的“冰”与“火”之歌
近年来,以免疫检查点抑制剂(ICIs)为代表的癌症免疫疗法,为无数患者带来了生命的曙光。它通过“松开”免疫系统的“刹车”,让T细胞等免疫卫士能够重新识别并攻击癌细胞。然而,一个严峻的现实是:并非所有患者都能从免疫治疗中获益。
科学家们发现,这背后的关键在于肿瘤微环境(TME)的“温度”——肿瘤被分为“热肿瘤”和“冷肿瘤”两大类。这并非指物理温度,而是免疫系统在肿瘤内部的活跃程度。
郑州大学代谢紊乱与食管癌防治全国重点实验室万香波、范新娟与口腔医学院何巍作为共同通讯作者,在Molecular Cancer(IF=33.9)在线发表了题为“Turning cold tumors into hot tumors to ignite immunotherapy”的论文。该论文解析了“冷肿瘤”形成机制,提出将其转化为“热肿瘤”的创新策略,为克服免疫治疗耐药提供前沿学术视角[1]。
“热肿瘤” (Hot Tumor):像一个激烈的战场,内部充满了大量浸润的免疫细胞(尤其是细胞毒性T细胞),它们正在积极地与癌细胞战斗。这类肿瘤对免疫治疗反应良好[2,3]。
“冷肿瘤” (Cold Tumor):则像一片免疫沙漠,几乎没有免疫细胞的踪迹,或者免疫细胞被阻挡在外围无法进入。癌细胞在这里安然无恙,免疫治疗也因此束手无策[4-7]。
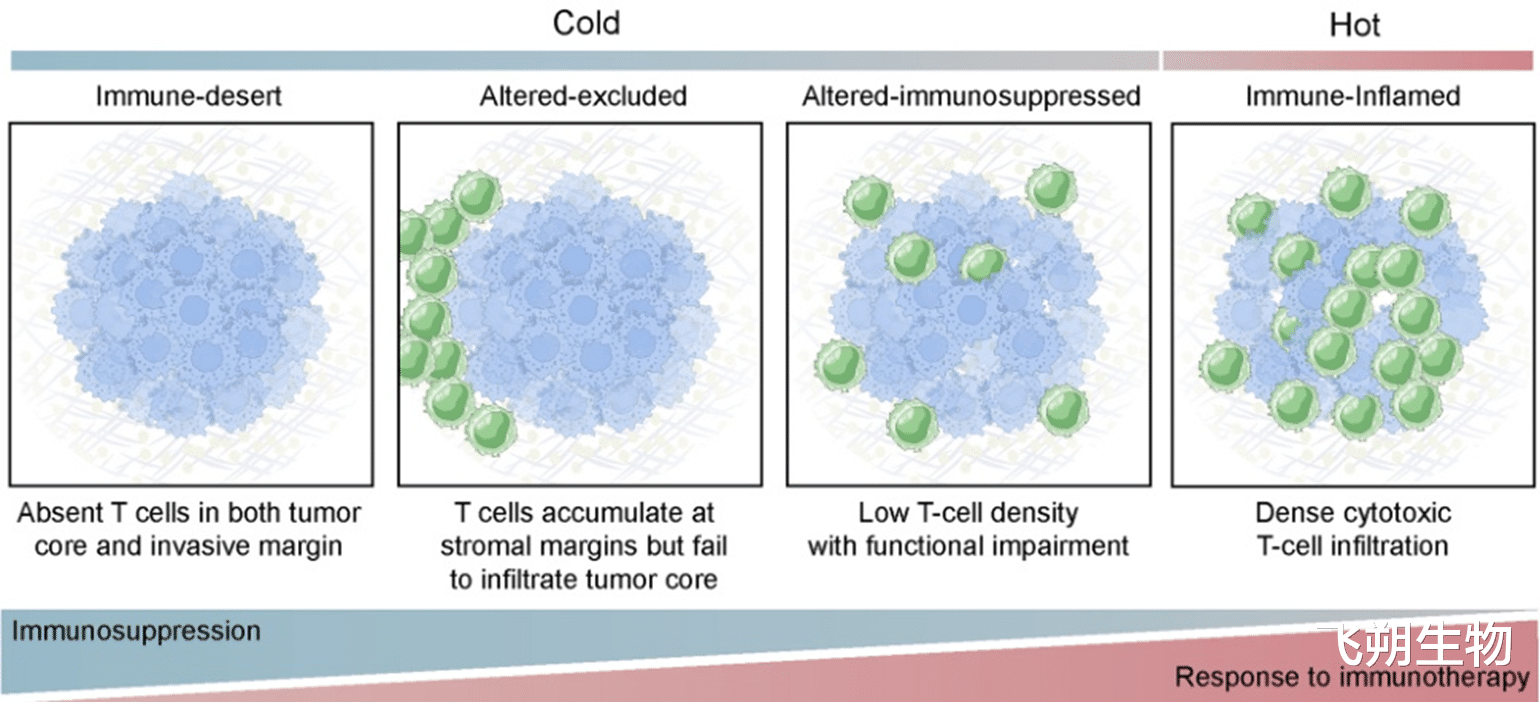
图1 肿瘤的免疫表型。从左至右展示了从“冷”到“热”的演变:免疫沙漠型(几乎无T细胞)、免疫排斥型(T细胞被阻挡在外)、免疫抑制型(T细胞功能受损),最终到免疫炎症型(即“热肿瘤”,T细胞大量浸润)。
因此,将“冷肿瘤”转化为“热肿瘤”,重新点燃抗肿瘤免疫反应,已成为当今癌症研究领域最核心、最具挑战性的课题之一。
肿瘤的“三板斧”:伪装、胁迫与自保
为了在人体内生存和发展,癌细胞演化出一套精密的免疫逃逸机制,可将其概括为“三板斧”:伪装(Camouflage)、胁迫(Coercion)和细胞保护(Cytoprotection)。这三大策略共同构建了“冷肿瘤”的免疫抑制微环境[8,9]。

图2 “冷肿瘤”免疫表型的三大核心机制——伪装、胁迫与细胞保护,及其对应的分子和细胞层面的具体策略。
第一板斧:伪装(Camouflage) ——免疫系统的“隐身术”
为了不被免疫系统发现,癌细胞首先学会了“隐身”。
关闭“身份识别”系统:免疫细胞通过识别癌细胞表面的特定“标签”(即通过MHC-I分子呈递的肿瘤抗原)来发起攻击。但癌细胞通过基因突变或表观遗传修饰,关闭或减少MHC-I分子的表达,让自己在免疫细胞面前“隐形”。
阻断“信号兵”通路:树突状细胞(DC)是免疫系统的“信号兵”,负责捕获肿瘤抗原并激活T细胞。冷肿瘤会分泌一些物质(如TGF-β、乳酸)来阻止DC的招募和成熟,从源头上切断免疫应答的启动。
构建“物理壁垒”:癌细胞会诱导周围的基质(ECM)变得致密、纤维化,像一堵墙一样阻止免疫细胞渗透。同时,肿瘤内部的血管系统也变得异常、扭曲,进一步阻碍免疫细胞的进入。
表观遗传“静音”:通过DNA甲基化、组蛋白修饰等手段,癌细胞能“关闭”那些本应吸引免疫细胞的趋化因子(如CXCL9, CXCL10)的基因表达,让免疫细胞找不到“路”。
第二板斧:胁迫(Coercion) ——打造“免疫抑制部队”
如果伪装失败,癌细胞还会主动出击,胁迫免疫系统“缴械投降”。
招募“叛军”:癌细胞会分泌多种信号,招募并“策反”一系列免疫抑制细胞,如M2型肿瘤相关巨噬细胞(TAMs)、调节性T细胞(Tregs)、髓源性抑制细胞(MDSCs)等。这些细胞形成一个强大的抑制网络,直接压制杀伤性T细胞的活性。
发动“代谢战争”:癌细胞是“大胃王”,它们疯狂消耗肿瘤微环境中的葡萄糖等营养物质,让T细胞“吃不饱饭”。同时,它们还产生大量乳酸等代谢废物,创造一个酸性、缺氧的“有毒”环境,进一步抑制免疫细胞功能。
操控“神经系统”:研究发现,肿瘤内的神经纤维也能被癌细胞利用。例如,交感神经释放的去甲肾上腺素会直接导致T细胞“耗竭”,而感觉神经元释放的CGRP肽则会抑制免疫监视。
第三板斧:细胞保护(Cytoprotection) ——练就“金钟罩铁布衫”
即使免疫细胞突破重重阻碍来到癌细胞面前,癌细胞还有最后一招——抵抗死亡。
破坏“死亡之吻”:T细胞与癌细胞的结合点被称为“免疫突触”,是传递“死亡信号”的关键。癌细胞通过下调ICAM-1等粘附分子,使这个连接变得不稳固,让T细胞的攻击失效。
关闭“自毁程序”:细胞焦亡(Pyroptosis)、铁死亡(Ferroptosis)等炎症性细胞死亡方式,本可以释放大量“危险信号”来激活免疫系统。但癌细胞通过表观遗传等方式,抑制了这些死亡通路关键蛋白(如GSDM家族)的表达。
启动“快速修复”机制:当T细胞在癌细胞膜上打孔(如释放穿孔素)时,癌细胞会迅速启动一套名为ESCRT的膜修复系统,像“补胎”一样快速修复损伤,从而逃脱死亡。
化冷为热:点燃免疫风暴的治疗策略
知己知彼,百战不殆。既然我们已经了解了肿瘤“变冷”的伎俩,科学家们也针锋相对地开发出了一系列“加热”策略。
策略一:瓦解伪装,让肿瘤无处遁形[10-14]
核心思想:打破物理和分子层面的屏障,恢复免疫系统的识别与浸润能力。
重塑趋化因子网络:通过直接向肿瘤内递送吸引T细胞的趋化因子(如CXCL9/10),或使用药物阻断吸引抑制性细胞的趋化因子受体(如CCR4),来“重新规划”免疫细胞的交通路线。
摧毁物理屏障:使用抗血管生成药物(如贝伐珠单抗)使肿瘤血管“正常化”,或使用酶(如透明质酸酶)降解致密的细胞外基质,为免疫细胞打开通道。
激活先天免疫“警报”:利用STING激动剂等药物,激活细胞内的天然DNA感知通路,强制癌细胞发出强烈的“危险信号”(I型干扰素),从而招募和激活DC与T细胞。
表观遗传重编程:使用DNMT抑制剂(如地西他滨)或HDAC抑制剂等药物,逆转癌细胞对免疫相关基因的“静音”,重新开启MHC和趋化因子的表达。
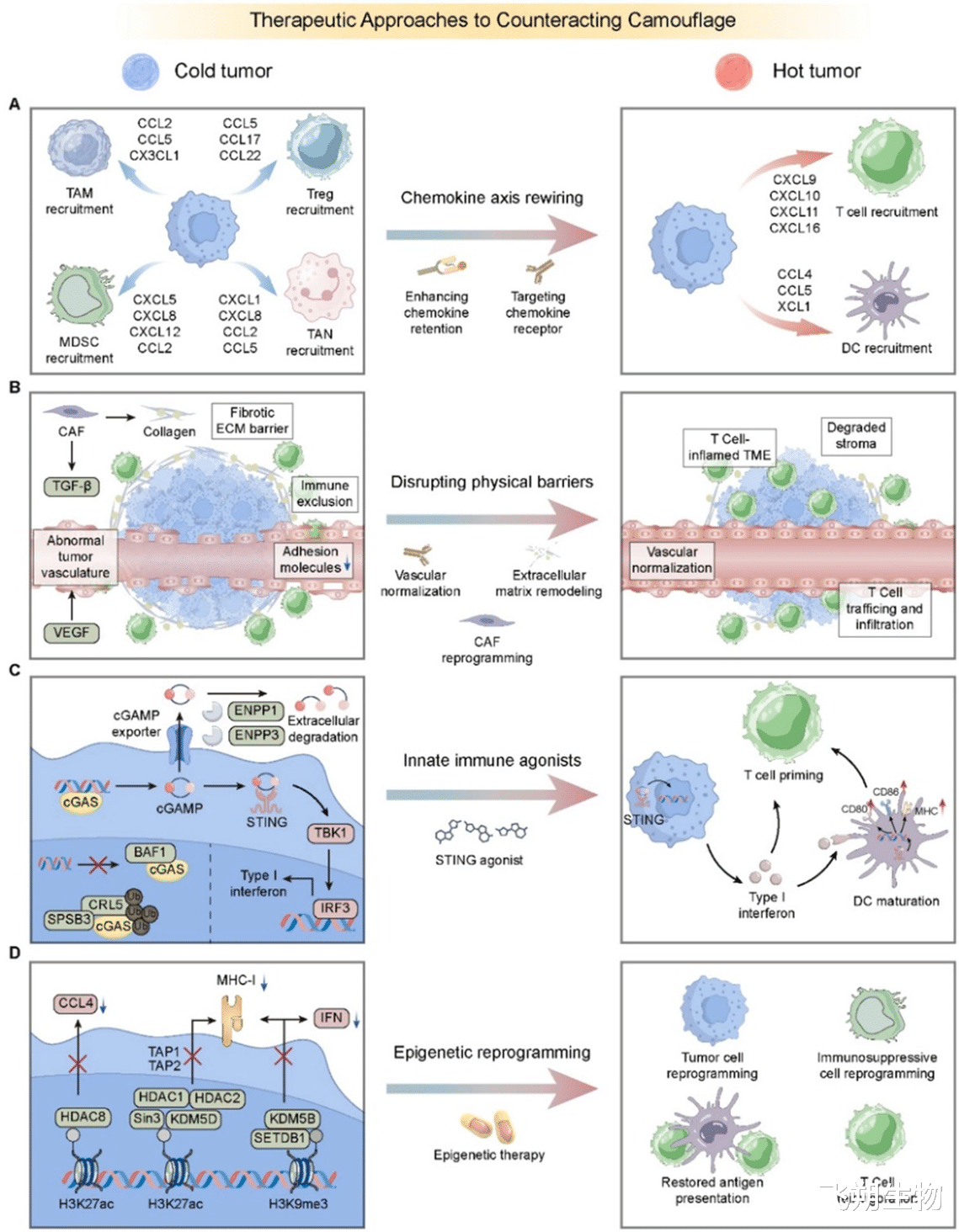
图3 对抗“伪装”的四大治疗策略,旨在通过重塑趋化因子轴、破坏物理屏障、激活先天免疫和表观遗传重编程,将冷肿瘤转变为热肿瘤。
策略二:粉碎胁迫,解除免疫抑制[15-19]
核心思想:清除或“再教育”免疫抑制细胞,纠正代谢紊乱,切断抑制信号源。
靶向抑制性细胞:开发药物或抗体,选择性地清除Tregs、MDSCs,或将M2型巨噬细胞“再教育”成具有抗肿瘤功能的M1型。
诱导三级淋巴结构(TLS):TLS是肿瘤内部形成的“微型淋巴结”,能有效支持T细胞的活化和增殖。通过递送特定细胞因子(如LIGHT)或激动剂,可以在肿瘤内诱导TLS的形成,建立持久的抗肿瘤免疫“前哨站”。
代谢干预:通过抑制癌细胞的关键代谢酶(如糖酵解或谷氨酰胺代谢抑制剂),不仅能“饿死”癌细胞,还能为T细胞夺回宝贵的营养,改善微环境。
微生物组工程:肠道菌群深刻影响着免疫治疗的效果。通过粪菌移植(FMT)、补充益生菌或调整饮食,可以重塑肠道微生态,培养有益菌群(如阿克曼菌),从而系统性地增强抗肿瘤免疫力。

图4 对抗“胁迫”的治疗策略,包括靶向免疫抑制细胞网络、代谢干预、神经-免疫轴阻断和微生物组工程,共同瓦解肿瘤的免疫抑制环境。
策略三:破解自保 诱导癌细胞死亡[20-23]
核心思想:强制启动癌细胞的死亡程序,并使其死亡过程充满“仪式感”,以最大程度地激活免疫系统。
诱导炎症性细胞死亡:利用溶瘤病毒、光动力疗法或特定化疗药物,诱导癌细胞发生焦亡,铁死亡等免疫原性死亡(ICD),这种死亡方式会释放大量“求救信号”(DAMPs),强烈激活DC和T细胞 ,将“冷”肿瘤转变为“热”肿瘤。
靶向ESCRT膜修复系统:开发ESCRT抑制剂,阻止癌细胞修复由免疫细胞,攻击造成的细胞膜损伤,这使得免疫细胞的攻击更为致命,并能增强焦亡等死亡方式的效果。
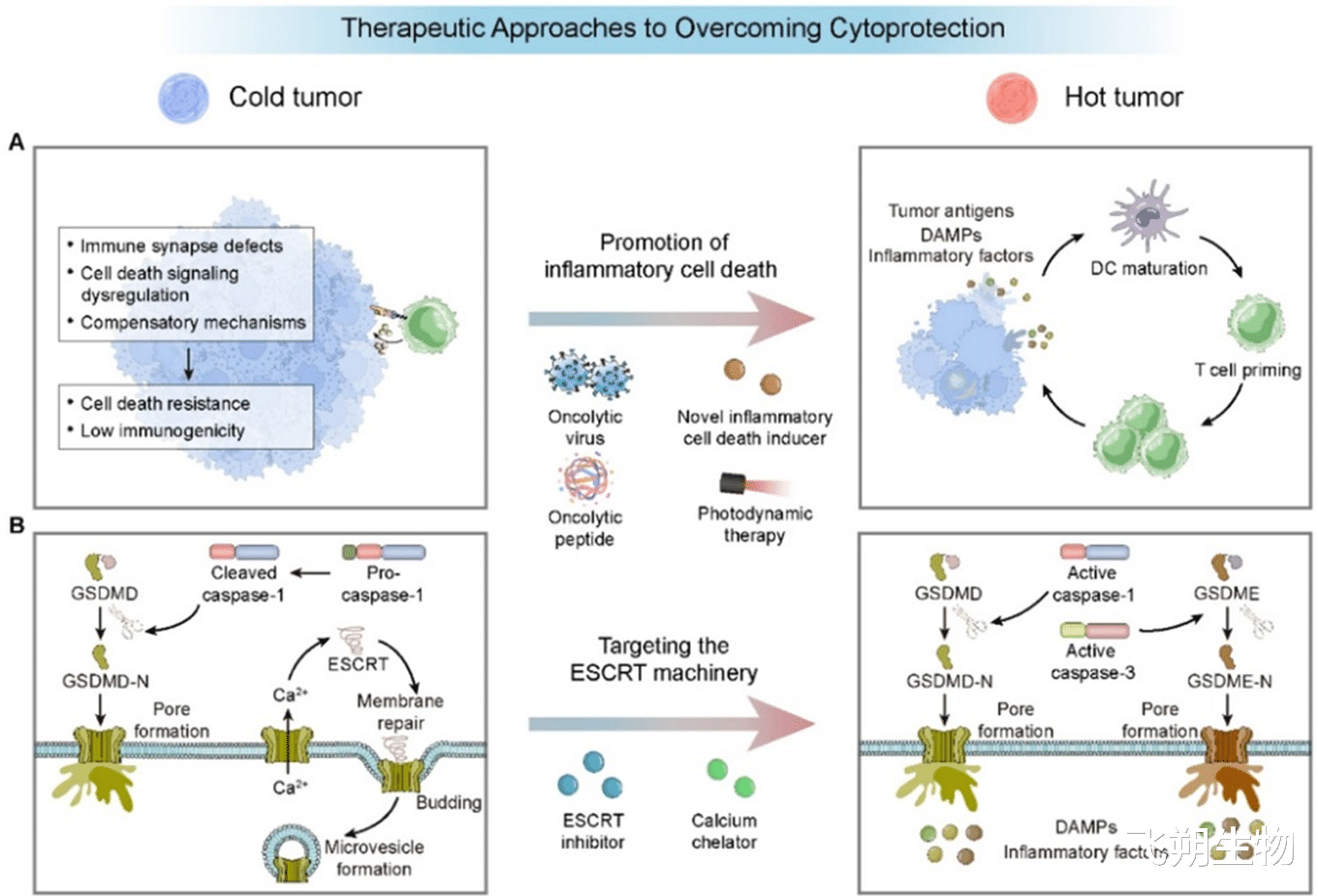
图5 克服“细胞保护”的治疗策略。通过诱导炎症性细胞死亡和靶向ESCRT膜修复机制,可以有效破解癌细胞的防御,并释放免疫刺激信号。
未来展望:精准“加热”的利器——生物材料与前沿科技
为了更精准、高效地实现“冷”转“热”,科学家们正在开发基于生物材料的创新递送系统。这些纳米级的“智能导弹”,如纳米凝胶、聚合物前药、仿生纳米载体等,能够将多种药物(如化疗药、免疫激动剂、代谢抑制剂)打包在一起,精准地递送到肿瘤部位,并根据肿瘤微环境的特定信号(如低pH、高ROS)智能释放,实现“多管齐下”的协同治疗。
将“冷肿瘤”转化为“热肿瘤”是一场复杂的系统性工程,它要求我们从分子、细胞到整个机体层面进行综合调控。尽管挑战重重,但随着我们对肿瘤免疫逃逸机制的理解日益深入,以及创新疗法和技术的不断涌现,我们有理由相信,在不远的将来,免疫治疗的火焰将能够点燃更多曾经“冰冷”的肿瘤,为更多癌症患者带来治愈的希望。
参考文献
[1] Mol Cancer. 2025 Oct 14;24(1):254.
[2] Nat Rev Cancer. 2024 Sep;24(9):629-646.
[3] Br J Cancer. 2023 Oct;129(8):1212-1224.
[4] MedComm (2020). 2023 Aug 26;4(5):e343.
[5] Immunity. 2023 Oct 10;56(10):2188-2205.
[6] Nat Rev Drug Discov. 2019 Mar;18(3):197-218.
[7] Clin Cancer Res. 2016 Apr 15;22(8):1865-74.
[9] Cancer Cell. 2024 Nov 11;42(11):1825-1863.
[11] Cancer Res. 2020 Nov 1;80(21):4754-4767.
[12] Mol Cancer. 2025 Jun 12;24(1):178.
[13] Adv Sci (Weinh). 2025 Jan;12(2):e2404432.
[14] Mol Cancer. 2021 Dec 20;20(1):171.
[17] Signal Transduct Target Ther. 2025 Jun 4;10(1):178.
[18] Cancer Cell. 2023 Mar 13;41(3):573-580.
[19] Nat Rev Drug Discov. 2024 Oct;23(10):780-796.
[20] Trends Cancer. 2025 Apr;11(4):376-402.
[21] Cell death. Cell. 2024;187:235–56.
[22] Science. 2022 Apr 22;376(6591):377-382.
[23] Cell Rep. 2022 Aug 16;40(7):111205.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!