在重症监护室(ICU)中,机械通气是挽救重症呼吸衰竭患者生命的基石。然而,机械通气模式参数设置不合理或长时间的机械通气,可能导致呼吸机相关性肺损伤(VILI)或呼吸机相关性膈肌功能障碍(VIDD)。VILI与VIDD不仅延长了患者的机械通气时间、ICU住院时间,影响患者的脱机成功率和长期预后。
近年来,膈神经刺激(Diaphragmatic Nerve Stimulation, DNS)作为一种新兴的治疗策略,为减少VILI/VIDD的发生和促进患者脱机提供了新的希望。
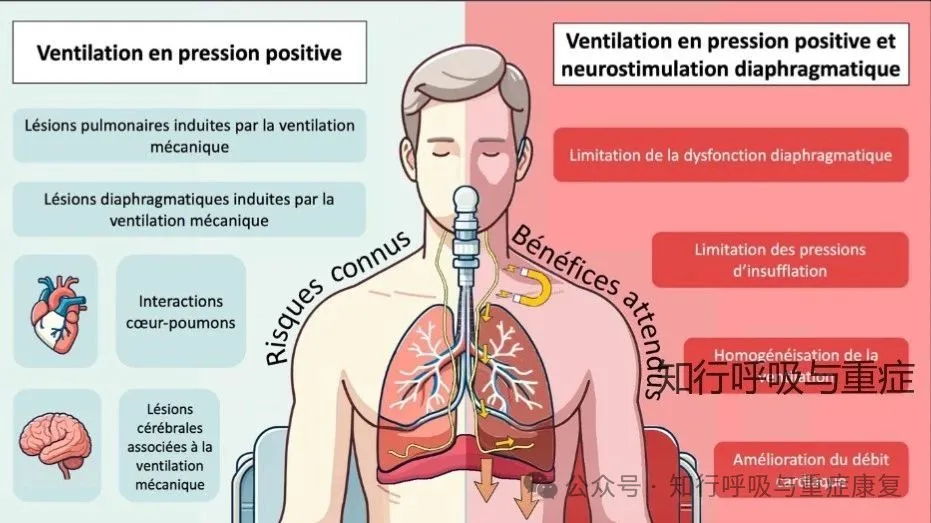
本文将探讨VIDD的机制、膈神经刺激的原理、临床应用、现有技术以及其在重症机械通气患者管理中的前景。
· 一、呼吸机导致的膈肌功能障碍 ·
机械通气对于膈肌来说是一把双刃剑,当呼吸机给的支持力度刚好是患者所需时,由于呼吸机承担了一部分的呼吸功,膈肌的活动度大幅度降低,从而膈肌得到了充分的休息,但如果呼吸机模式或者参数设置不合理,甚至出现人机对抗时就会出现膈肌损伤。

临床上呼吸机导致的膈肌功能障碍的可能机制大致包括四类,分别是:
· 1.1 过度支持性膈肌损伤·
过度支持性膈肌损伤(Over-assistance Myotrauma)
机制:通气支持过度,患者自主呼吸努力显著减少,导致膈肌“闲置”。
结果:膈肌因长时间失用发生萎缩(disuse atrophy)。
临床表现:MIP下降,膈肌增厚分数降低,脱机困难。
· 1.2 支持不足性膈肌损伤·
支持不足性膈肌损伤(Under-assistance Myotrauma)
机制:通气支持不足,在高呼吸驱动状态下,膈肌需承受高负荷收缩(向心性收缩)。
结果:肌肉张力升高,导致炎症浸润、肌纤维结构破坏(肌节、肌膜受损)。
易发生场景:ARDS患者未给予足够支持;CPAP/NIV中患者呼吸衰竭仍进行性的加重。
· 1.3 离心性膈肌损伤·
离心性肌损伤(Eccentric Myotrauma)
机制:膈肌在被动拉长状态下收缩,常见于呼吸机不同步(如反向触发)。
特点:膈肌在呼气期强行收缩,而呼吸机此时正在送气或已经送气结束,导致拉伤。
后果:结构破坏更严重,可能诱发长期功能损害。
· 1.4 纵向萎缩·
纵向萎缩(longitudinal atrophy)
机制:高PEEP下膈肌持续处于缩短状态,肌纤维被压迫、变形。
结果:产生纵向萎缩,损害膈肌的长度-张力关系。
易被忽视:不同于厚度变化,长度改变更难被常规影像发现。
机械通气时,膈肌萎缩与力学功能下降,除了导致呼吸机相关性膈肌功能障碍(VIDD)以外,还可能因肺应激与肺应变增加,导致呼吸机相关性肺损伤(VILI);也可能因心输出量下降、脑灌注受损,甚至诱发呼吸机相关性脑损伤(VABI),这使得维持膈肌在机械通气期间适当主动呼吸成为新的治疗目标。因此,目前都在提倡肺保护性通气与膈肌保护性通气,往期公众号已有整理,感兴趣的读者可点击→第151期 膈肌保护性通气的机制与实施,一文整理!
除了保护性通气外,膈神经刺激(DNS)在机械通气患者的临床应用研究也越来越多!
·二、膈神经刺激 ·
膈神经刺激(DNS)的核心原理在于通过电或磁脉冲间歇性地刺激膈神经,诱发膈肌收缩,从而模仿自主呼吸,达到锻炼和维持膈肌功能的目的。因为通过电极刺激膈神经可诱发被动的膈肌收缩,即使在深度镇静或神经肌无力患者中也可实现。
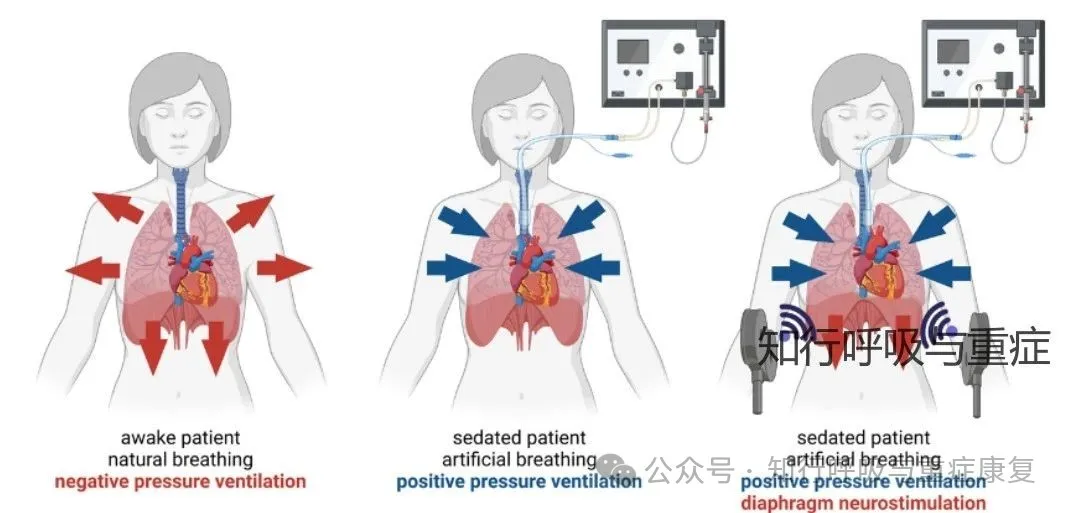
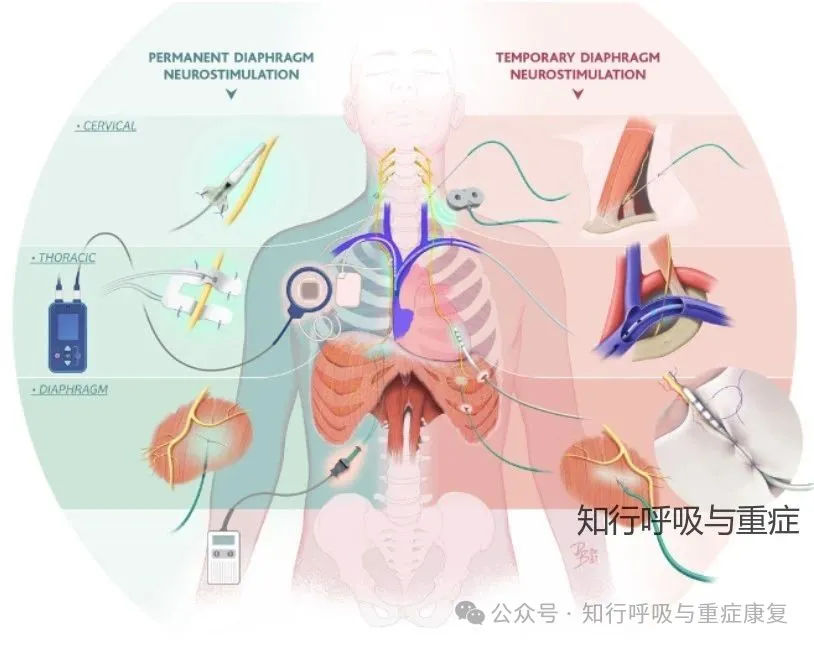
膈神经(图中红色)在颈部及胸腔内的解剖走行如下:
膈神经起源于颈椎C3至C5节段的脊神经根,在颈部穿行于前斜角肌的外侧向内侧走行,随后进入胸腔。进入胸腔后,膈神经处于纵隔胸膜与心包之间,经肺门前方向下走行,左侧膈神经沿左心室前方下降,右侧则沿右心房前方下降,最终进入并支配膈肌。
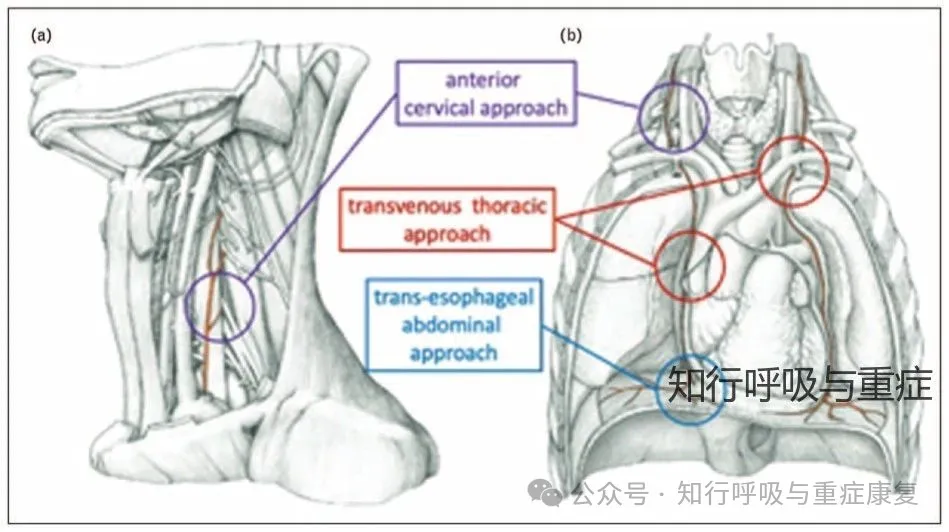
因此,根据膈神经的走行,针对重症患者,可选择多种途径实施膈肌神经刺激(PNS)。

根据刺激方式的侵入性和所采用的能量形式,膈神经刺激技术可分为三大类
· 2.1 侵入性电刺激(Invasive PNS)·
这类方法在ICU及慢性通气依赖患者中应用广泛,包含以下进路:
1. 经皮电刺激(Percutaneous Electrical PNS):利用刺激针精准靠近颈部膈神经,其特点是创伤小、操作相对简便,适合床旁训练或膈肌功能检测。
2. 手术电极植入(Surgical Intramuscular PNS):用于高位截瘫患者,通过手术将电极植入膈肌神经入点,可实现慢性膈肌起搏通气。
3. 简易手术植入:避免膈神经剥离,在心包与膈肌之间末端神经段放置可移除电极,此方法目前仅在实验阶段(仅限尸体和动物模型中)。
4. 经静脉临时电刺激(Temporary Transvenous PNS, TTDN):通过单根中心静脉导管携带多个电极;此方法可同时刺激左右膈神经,在ICU中最具潜力,已用于脱机训练等研究中。
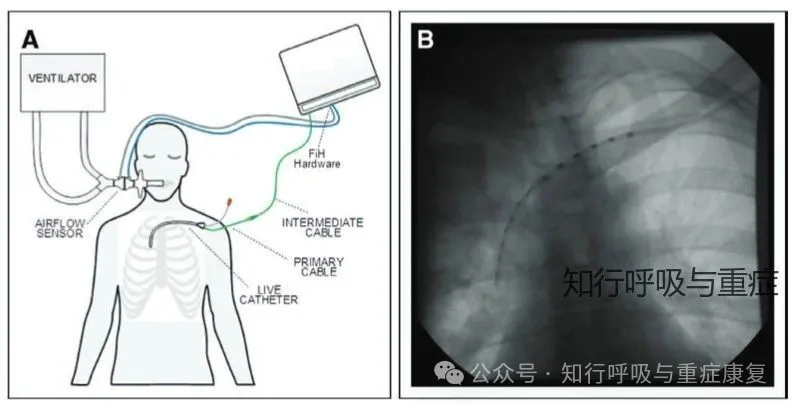
·2.2 非侵入性电刺激(Non-invasive Electrical PNS) ·
通过皮肤表面电极,跨越皮肤和软组织刺激膈神经。此方法安全性高、无创,可用于床旁功能评估或训练,但刺激电流扩散大、精准度较低,难以在深部结构诱发强烈收缩,适用于低风险人群或早期功能训练探索。
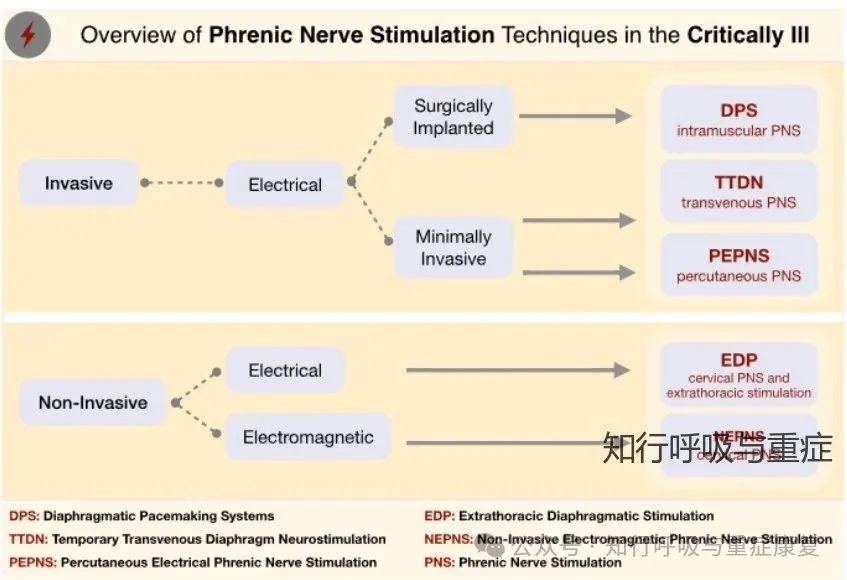
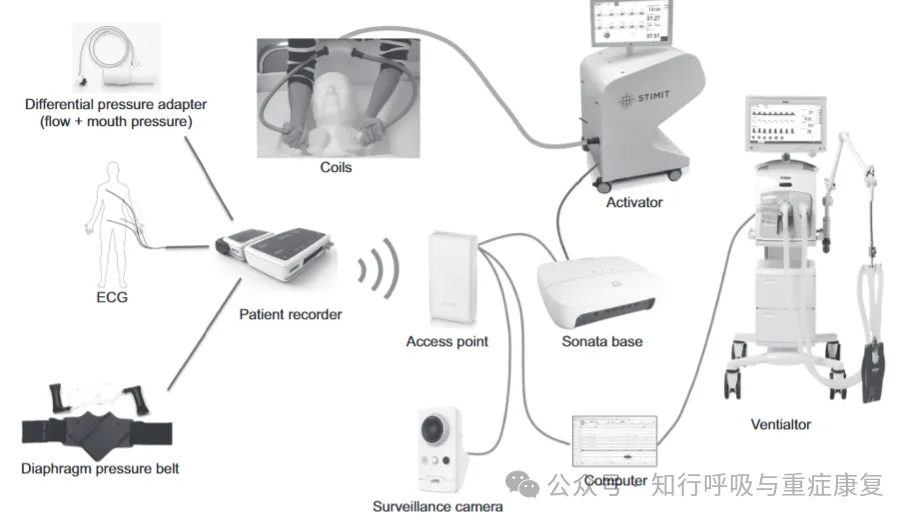
· 2.3 非侵入性电磁刺激(Non-invasive Electromagnetic PNS, NEPNS)·
利用电磁场穿透组织,在深部诱发膈神经兴奋;
初代设备由Sanders等人在2010年提出,使用蝶形磁刺激线圈进行实验;这个方法的优点是清醒状态下可操作以及与治疗时不干扰ICU其他设备;缺点也相当明显,比如初代设备过于笨重以及难以精准聚焦等
· 2.4 电刺激or磁刺激? ·
电刺激与磁刺激是目前膈神经刺激的两种主要技术路径,各具优势与局限。磁刺激由于操作简便、定位迅速,常用于膈肌功能的评估与跨膈压(Pdi)测量,在诊断应用中更具优势。然而,这种选择性较差,当刺激时可能同时激活臂丛神经、辅助吸气肌群以及异位膈神经,导致跨膈压较真实膈肌收缩高出20–25%。
而电刺激通过针电极或导管可精确定位膈神经主干,刺激特异性强,更适合用于膈肌训练及重症患者治疗。目前,电刺激是唯一被证实可在ICU中成功用于膈肌激活的技术,因此,临床选择应依据诊断目的、患者基础情况及设备条件综合评估。
· 三、膈神经刺激的临床应用 ·
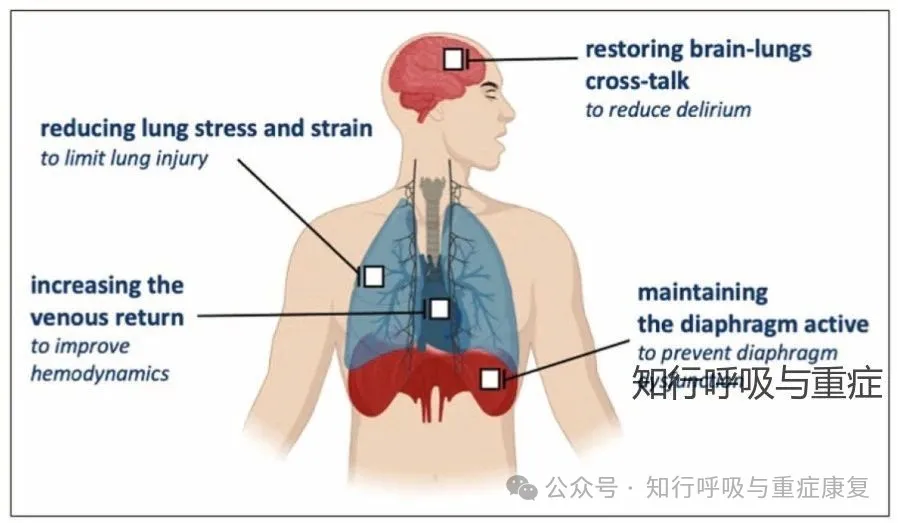
· 3.1 维持膈肌活动·
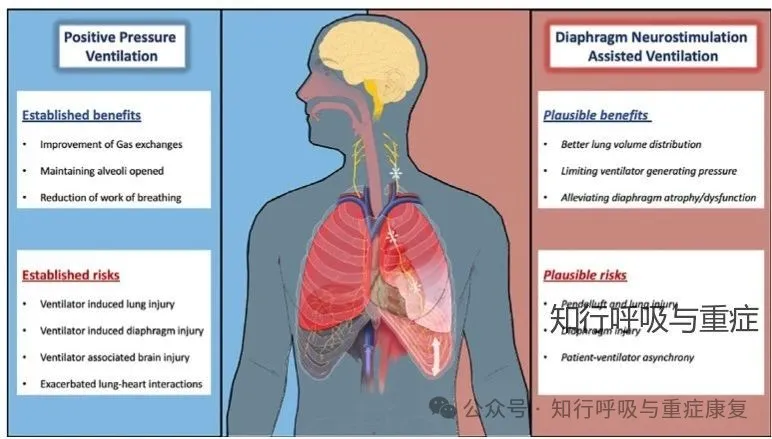
维持适度的膈肌收缩活动被认为有助于预防由正压通气诱发的膈肌压力产生能力下降。基于这一病理生理机制,膈神经刺激辅助通气(diaphragm neurostimulation assisted ventilation)被视为实现“膈肌保护性通气(diaphragm-protective ventilation)”的重要手段。动物实验已证实,膈神经电刺激可有效减少膈肌萎缩、纤维损伤与排列紊乱,为临床应用提供了生物学依据。其次多个病例报告和队列研究表明,即便在损伤数年后,永久性膈神经刺激装置仍可以改善膈肌厚度与最大吸气压力,部分患者甚至成功脱离长期机械通气。
· 3.2 减少VILI·
呼吸机相关性肺损伤(VILI)一直是ICU机械通气患者值得关注的问题,其机制在往期公众号已有整理,感兴趣的读者可点击→第180期 一文了解呼吸机相关性肺损伤的发生发展机制
在ARDS患者中,为实现肺保护性通气,临床上常使用深度镇静抑制患者自主呼吸,以避免呼吸机-患者不同步,但这也导致了膈肌收缩活动被抑制,进而造成背侧肺不张,加重通气区域不均一性,增加肺部应力集中现象。研究表明,膈神经刺激辅助通气(diaphragm neurostimulation assisted ventilation)可通过激活膈肌收缩,使通气从以往偏向非重力依赖肺叶的分布转移至背部重力依赖塌陷区域,从而改善肺顺应性、维持功能残气量,并减轻区域肺应力负荷。
· 3.3 改善血流动力学·
正压通气增加了右心房压力、降低了左心室降跨壁收缩压,并减少了静脉回流及左心排血的压力梯度,尤其在存在容量依赖性时更为显著。最终结果可能是心输出量下降。
而膈肌自主收缩时产生的负压吸气机制在生理上具有与正压通气相反的血流动力学效应,所以理论上膈神经刺激诱导的膈肌收缩可恢复这一“呼吸泵”功能,从而有望改善右心功能、优化肺通气的均匀性并降低肺血管阻力,最终实现对右心和左心舒张末期容量的保护。在动物实验(羊模型)中,单独施行膈神经刺激不仅实现了有效肺泡通气,且可逆转正压通气导致的心输出量下降。
· 3.4减少脑损伤 ·
正压机械通气不仅影响肺部和循环系统,还可能通过“肺–脑轴”与中枢神经系统产生复杂交互,潜在诱发脑功能障碍甚至结构性损伤。肺部牵张受体在通气过程中感受到的牵张或压力信号可通过迷走神经及自主神经系统传递至中枢神经系统,同时激活一系列神经、炎症、免疫及内分泌信号通路。
虽然在非颅脑损伤、非脑卒中等典型神经系统病变的ICU患者中,“脑损伤”暂时没有无统一定义,但最常见表现为谵妄(机械通气的患者中高达60–80%),谵妄的发生增加了患者死亡率、机械通气时间。
而在联合膈神经刺激的动物中,这种脑部损害显著减轻,表现为凋亡减少与炎症反应减弱。虽然其机制尚未完全阐明,但可能与以下因素有关:
1.肺部炎症反应的减弱,减少肺源性炎症因子通过血液影响脑组织;
2.迷走神经调节增强,改善交感/副交感神经系统平衡,降低脑部过度应激;
3.呼吸肌激活带来的“生理感知”刺激,有助于维持神经可塑性与认知功能。
因此,在长期机械通气、深度镇静状态下,膈神经刺激可对预防ICU相关脑功能障碍具有一定前景。
· 总结 ·
近年来,大家都在提倡膈肌保护性通气和肺保护性通气,而膈神经刺激作为一种创新性的辅助通气策略,可以为我们提供了一种主动维护膈肌功能、减少机械通气相关并发症的全新思路。
尽管当前的临床证据仍以动物实验、病例报告及少量随机对照试验为主,技术成熟度和可及性仍有限,但膈神经刺激所代表的“器官协同保护理念”已为我们指明了呼吸支持与重症康复的未来方向。在未来,随着设备微创化、参数智能化及适应证明晰化,膈神经刺激有望成为机械通气管理中的有力补充工具。
· 参考文献 ·
[1]Etienne H, Morris IS, Hermans G, et al. Diaphragm Neurostimulation Assisted Ventilation in Critically Ill Patients. Am J Respir Crit Care Med. 2023;207(10):1275-1282. doi:10.1164/rccm.202212-2252CP
[2]Pellegrini M, Parfait M, Dres M. How to protect the diaphragm and the lung with diaphragm neurostimulation. Curr Opin Crit Care. 2025;31(1):70-77. doi:10.1097/MCC.0000000000001233
[3]Panelli A, Verfuß MA, Dres M, Brochard L, Schaller SJ. Phrenic nerve stimulation to prevent diaphragmatic dysfunction and ventilator-induced lung injury. Intensive Care Med Exp. 2023;11(1):94. Published 2023 Dec 18. doi:10.1186/s40635-023-00577-5
[4]Dres, Martin, and Vincent Joussellin. "Neurostimulation diaphragmatique en réanimation: techniques, faisabilité, et potentielles indications." Médecine Intensive Réanimation (2024).
[5]Reynolds S, Ebner A, Meffen T, et al. Diaphragm Activation in Ventilated Patients Using a Novel Transvenous Phrenic Nerve Pacing Catheter. Crit Care Med. 2017;45(7):e691-e694. doi:10.1097/CCM.0000000000002366