说明:Tafel曲线是评估电催化剂反应动力学最常用、也最核心的工具之一。本文将系统介绍塔菲尔曲线的定义、原理、分析方法、注意事项。
什么是Tafel曲线?
在一张典型的Tafel曲线图中(图1 b),你会看到一条直线区域,这条直线区域就是Tafel区。在这个区域内,电化学反应的速率由电荷转移步骤控制,即反应本身的速度是决定因素。
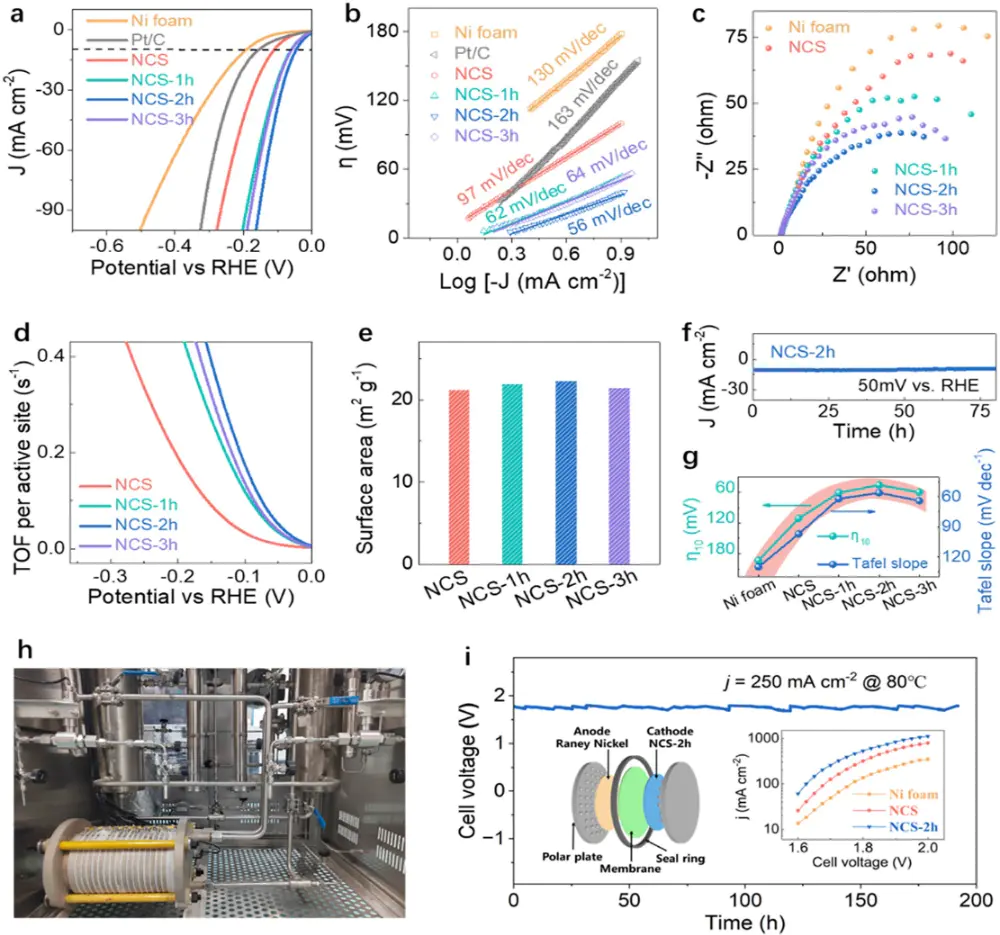
图1(b)由a中LSV曲线得出的塔菲尔斜率图。10.1021/jacs.5c09493
将Tafel区的直线反向延长至过电位为零(η=0)处,对应的电流密度就是交换电流密度j0。这是一个极其重要的动力学参数,代表了反应在平衡状态下的内在活性。j0值越大,电极的催化活性越高。
通过分析Tafel直线的斜率b值,可以推断出该电化学反应的可能机理,例如,对于HER反应,不同的b值对应Volmer、Heyrovsky或Tafel步骤为决速步。
Tafel分析的理论依据
Tafel曲线的理论基础是Butler-Volmer方程,该方程描述了电极电位与反应电流之间的内在联系。
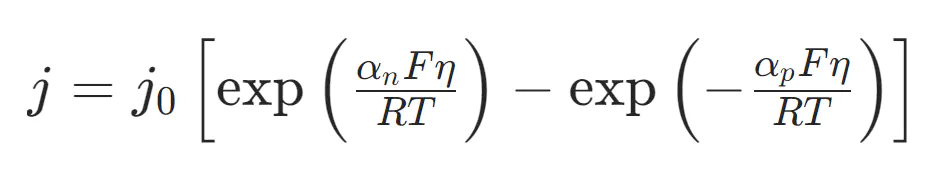
其中,j为净电流密度;j0为交换电流密度;αn为阴极转换系数;αp为阳极转换系数;η为过电位。
经典的Butler-Volmer方程较为复杂,当过电位足够大时(|η≥0.12V|),方程中某一方向的指数项会远大于另一项,可忽略次要项将方程整理为:
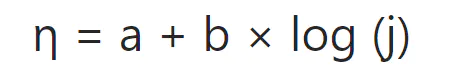
物理意义:Tafel方程表明,在一定过电位范围内,过电位与电流密度的对数呈线性关系,Tafel斜率b值越低,意味着催化剂的动力学性能越好,能用越小的能量代价获得越高的反应速率。
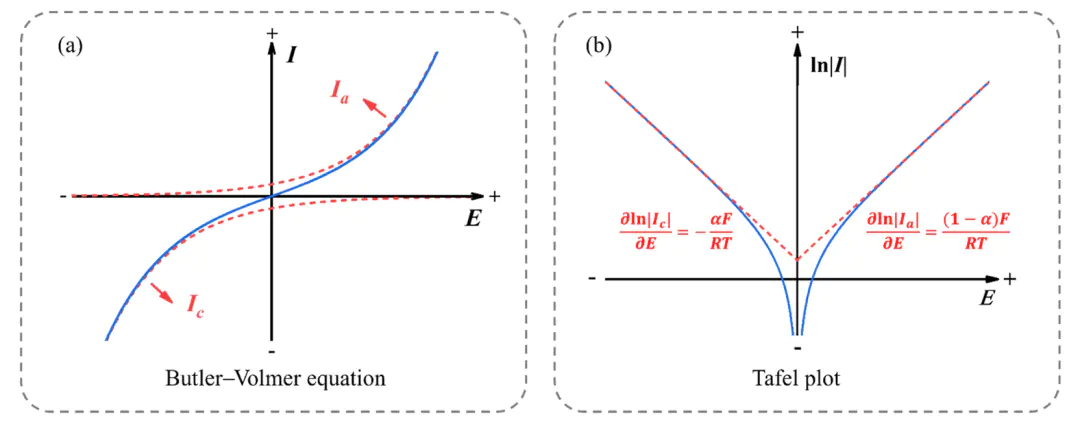
图2 B-V和Tafel区域的电流-电位关系。10.1063/5.0175156
以上方程适用于线性扫描伏安法(LSV)与计时电流法(CA)测试,而电化学阻抗谱(EIS)测试可通过过电位与电荷转移电阻倒数的对数关系拟合,同样可获得Tafel斜率:

其中,Rct为电荷转移电阻,单位为欧姆(Ω),反映电极表面电荷转移过程的难易程度。
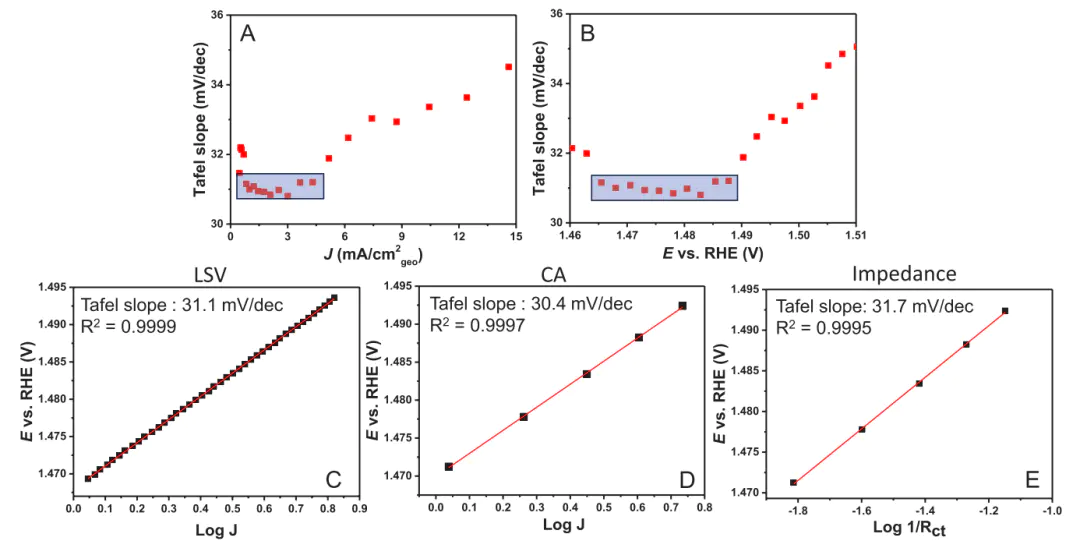
图3(A)Tafel斜率与平均电流密度关系,(B)与平均电位关系;(C-E)分别通过LSV、CA、EIS法测得的Tafel斜率。10.1021/acsenergylett.4c00266
Tafel斜率图
要获得有意义的塔菲尔斜率,必须严格控制实验条件,排除非动力学因素的干扰。传统的塔菲尔分析是在一条(看似)直线的区域进行线性拟合,从而得到斜率b和截距a。
然而,这种方法存在一个巨大隐患:你选择的“线性区域”可能并非真正的动力学控制区!此时可以在很小的电位窗口内(例如10 mV)连续计算并绘制塔菲尔斜率,然后将这些斜率值对平均电流密度或平均电位作图,即塔菲尔斜率图。
如果在某个电流或电位范围内,塔菲尔斜率图出现一个水平的平台区,那么该平台对应的塔菲尔斜率值就是一个具有明确动力学意义的“本征”值,若持续变化没有水平区域,则说明测得的塔菲尔斜率受到非动力学因素的严重干扰。
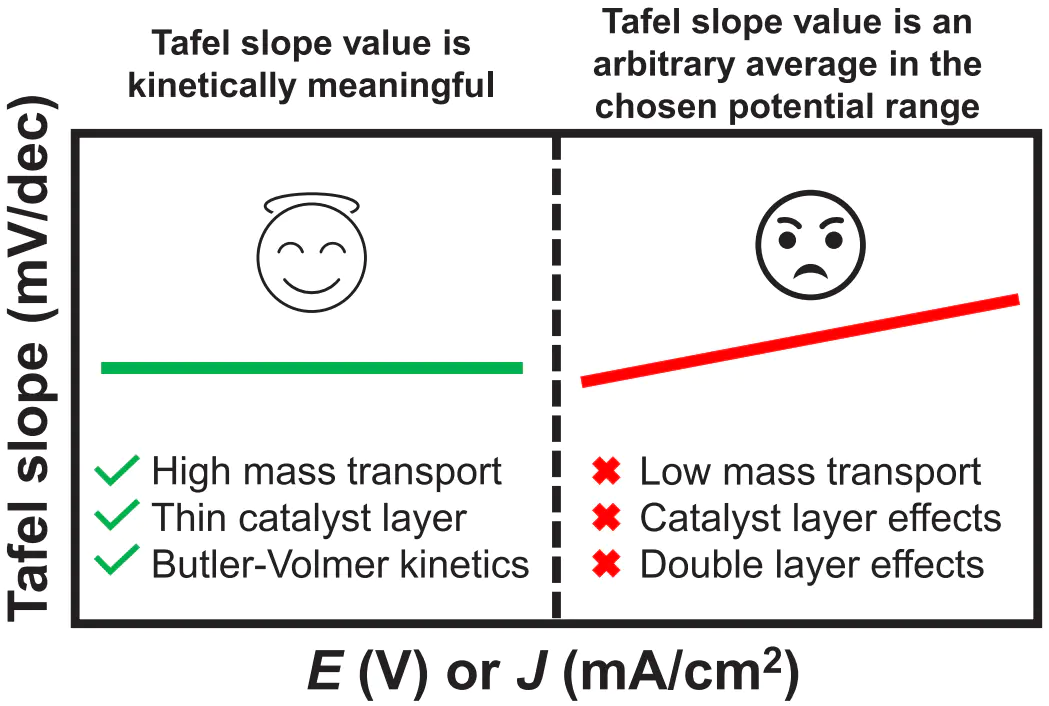
图4 10.1021/acsenergylett.4c00266
注意事项
避免非水平区域拟合:未出现水平区域的微分塔菲尔曲线不能随意拟合提取参数,如图5B、D碱性条件下铂电极HER反应和金电极CO₂RR反应的塔菲尔曲线无水平区域,此时拟合结果为任意电位区间的平均值,不具备动力学意义;
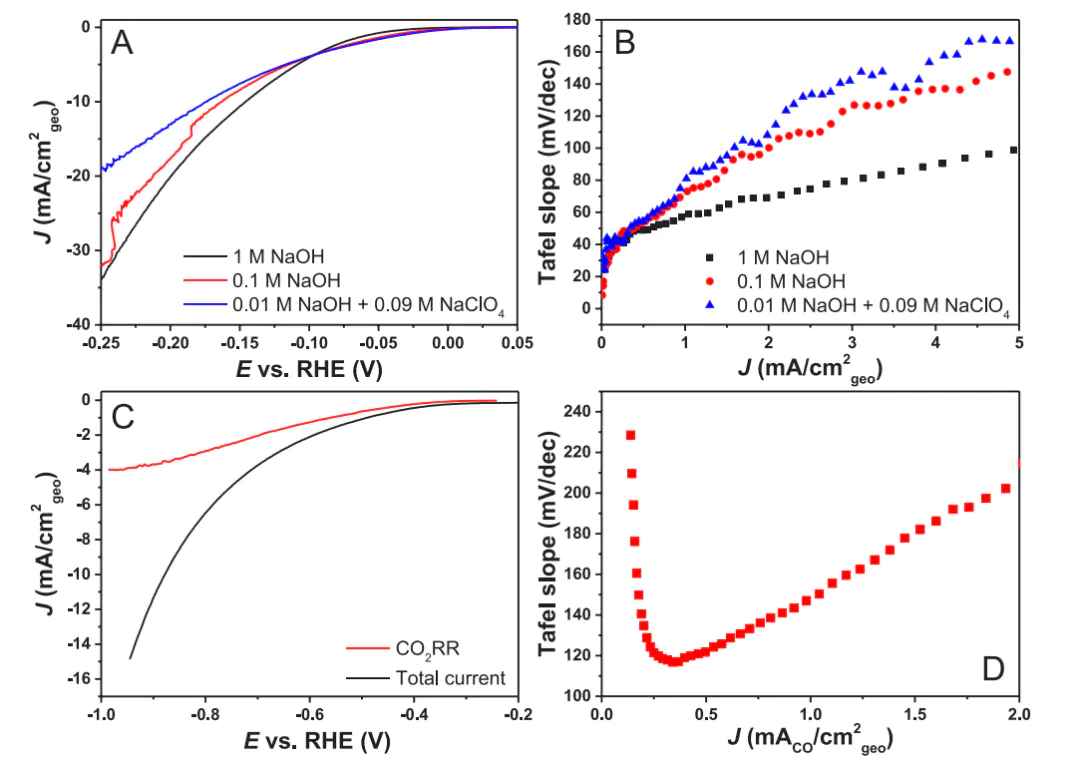
图5 10.1021/acsenergylett.4c00266
禁止使用瞬态技术数据:无论扫描速率多低,LSV/CV等瞬态极化曲线均无法反映稳态条件,导致表面中间体覆盖度无法达到0或1的理想假设。且瞬态技术难以实现100% iR降补偿,即使补偿,仍存在电容电流干扰。
替代方案:采用控制电位法(如计时电流法CA)获取稳态极化曲线。
必须完全消除iR降影响:Butler-Volmer方程假设过电位η仅含活化过电位,需通过电化学阻抗谱(EIS)或正反馈补偿校正。建议使用三电极体系减小溶液电阻。对高阻抗体系(如非水电解液),需实时iR补偿。
选择平衡电位120 mV以外的拟合区间:确保逆向反应电流贡献50 mV。HER/HOR等低过电位反应必须严格遵循120 mV规则。