上一期整理了自主神经系统的结构与功能→第230期 自主神经系统的结构与功能,我们知道交感神经系统和副交感神经系统在大脑皮质和丘脑下部等高级神经中枢的调控制约下,对机体内在生理功能上的调整和平衡,对各种内、外界环境变化或突变的动态应对。
而在临床上,因为各种各样的因素的影响,COPD患者自主神经功能紊乱普遍存在,且主要体现为交感神经活性亢进、迷走神经功能减退或二者失衡,从而有以下表现:
· 一、慢阻肺患者的自主神经系统 ·
如同躯体神经系统主要支配肌肉运动一样,自主神经系统(ANS)负责感受内环境变化并调控内脏活动。它也具备“感受器—传入神经—中枢—传出神经—效应器”的反射弧结构。
如前公众号上一期文章提到的,交感神经和副交感神经的解剖结构自中枢到外周可分为节前神经元、神经节和节后神经元三个层次,功能上既能快速协调全身反应,又能对局部器官实现精细调控。
COPD患者的自主神经异常可影响整个反射弧的各个环节,包括:
感受阶段 → 传入神经传导 → 中枢整合处理 → 传出神经传导 → 效应器反应。
无论哪个环节功能受损,反射弧的完整性和稳定性便会受到破坏。
·一、COPD患者自主神经功能障碍关键感受器 ·
目前认为COPD患者自主神经功能障碍中起关键作用的感觉感受器包括:
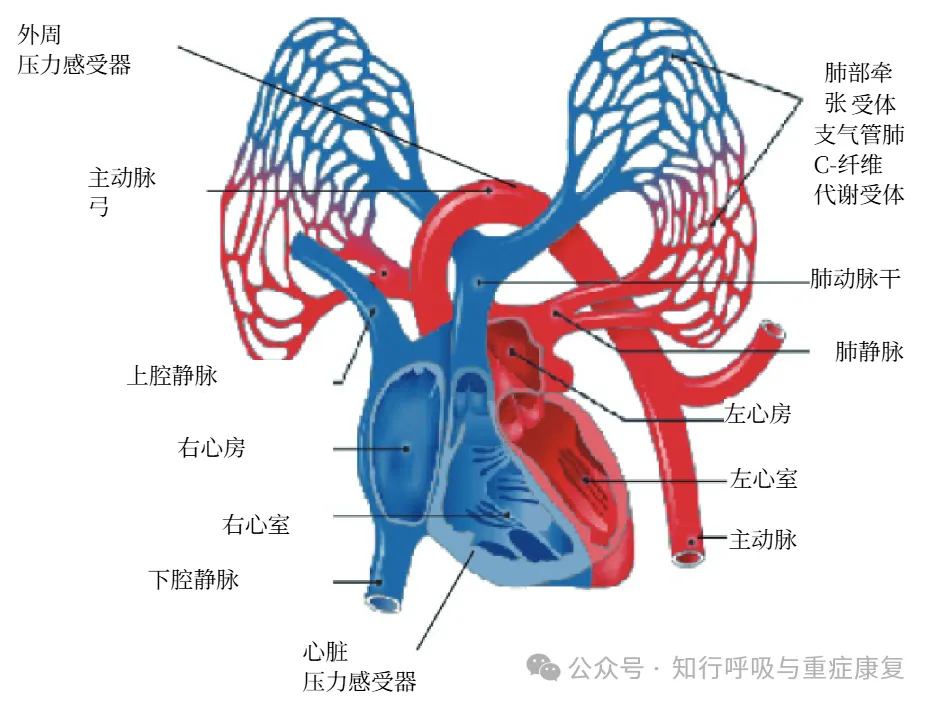
动脉及心脏压力感受器;
代谢及肺部牵张感受器;
支气管-肺C纤维感受器;
化学感受器。
· 2.1 动脉化学感受器·
Ⅱ型呼吸衰竭的慢阻肺患者通常表现为低氧血症与高碳酸血症共存,对自主神经系统产生复杂的影响。
1.缺氧(低氧血症)的影响
短期/急性缺氧:会通过外周化学感受器(颈动脉体+主动脉体),让自主神经系统中的 “交感神经” 变活跃。
1)研究证据:健康人如果突然缺氧,交感神经活动会明显增加;而且缺氧越严重,肌肉里的交感神经就越活跃(Saito 等的研究)。肌肉血管不仅不会舒张,反而会收缩,收缩肌肉血管,减少流向肌肉的血液,将更多血液 “调配” 到大脑、心脏等对缺氧更敏感的重要器官,维持核心生命功能。
2)缺氧的可逆性:给患者做短期氧疗(补氧),能改善心脏的自主神经调节功能,说明缺氧是轻度慢阻肺患者自主神经紊乱的重要原因。
此外,短期氧疗可显著改善心脏自主神经调节功能,提示低氧是轻度COPD患者自主神经功能紊乱的重要驱动因素。
2.二氧化碳潴留(高碳酸血症)的影响
主要通过中枢化学感受器(位于延髓)作用,间接影响自主神经功能。低氧与高碳酸血症往往并存,对自主神经形成双重干扰。
· 2.2 动脉及心脏压力感受器·
外周压力感受器主要位于颈动脉窦和主动脉弓,负责感知动脉血压变化;
在正常情况下,动脉血压在呼吸周期中呈现一定波动—吸气时血压下降,呼气时血压升高。而在COPD患者中,其功能及介导的压力反射敏感性会受多重因素影响,进而干扰自主神经功能,多项研究证实,COPD患者对短暂血压升高的压力反射敏感性明显下降;而压力反射敏感性受损会通过抑制性传入通路,直接导致患者交感神经活性增强。具体机制可分为机械性影响与非机械性因素两类。
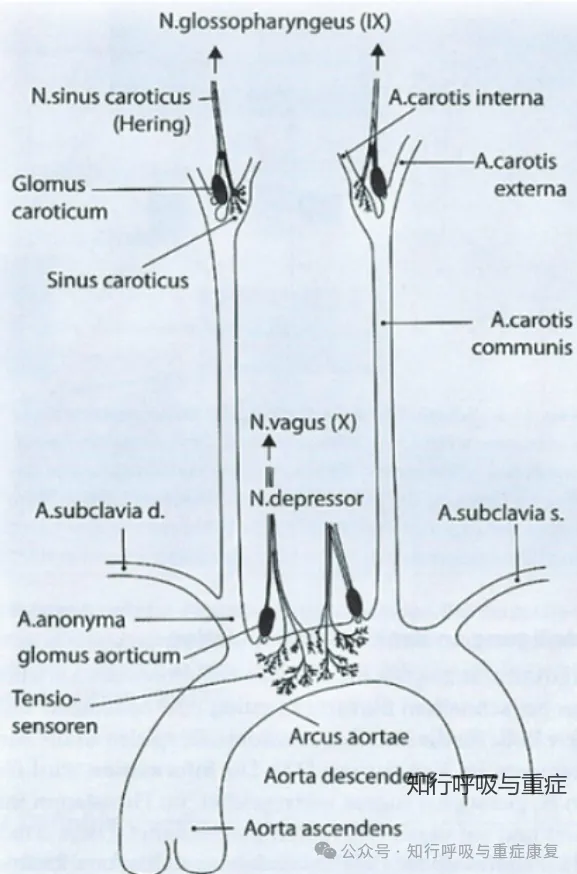
1.COPD 患者中压力感受器的机械性影响因素
1)胸内压波动的直接作用:COPD患者存在显著胸腔内压波动(辅助肌、腹肌过度参与),这种波动会传导至心脏及大血管,直接改变外周压力感受器的敏感性,同时影响心脏泵血性能与系统性血压;血压变化又会诱发胸内外压力感受器介导的心率补偿性调节,形成连锁反应。
2)异常呼吸与跨壁压干扰:患者异常呼吸模式会增大主动脉跨壁压梯度,进一步干扰胸腔内压力感受器功能;即便健康人,阻力性负荷呼吸也会激活主动脉压力感受器、改变自主神经活动,可见呼吸相关机械变化对压力感受器的影响具有普遍性。
3)心脏相关机械信号的作用:与呼吸相关的心脏跨壁压波动、心房牵张及静脉回流变化等机械机制,可通过心脏压力感受器被感知,最终同样影响COPD患者的自主神经功能。
2.非机械因素
影响压力反射敏感性的非机械因素:除上述机械因素外,还有两类关键因素参与压力反射敏感性下降
1)外周化学感受器与动脉压力感受器反射存在相互作用,且低氧会显著改变压力反射敏感性,高碳酸血症则不会;
2)肺动脉压升高会进一步削弱患者的压力反射调节功能。
· 2.3 代谢感受器·
在慢性肺疾病患者中,由于严重的气道阻塞与限制性通气障碍,呼吸做功显著增加,这可能通过局部代谢感受器的激活而引发交感神经系统兴奋。
已有研究表明,肌肉收缩(如等长运动)时产生的氧自由基及代谢产物(如乳酸、自由基)可刺激局部感受器(如肌梭外的代谢敏感性神经末梢),导致心率加快、动脉压升高及交感神经活动增强,且健康个体中反复呼吸肌收缩引发的肌肉疲劳,也能通过代谢反射通路增强交感神经兴奋反应。不过,代谢感受器在 COPD 患者心脏自主神经功能障碍中的具体作用尚未得到充分研究;鉴于 COPD 患者常存在膈肌结构重塑甚至膈肌损伤,可合理推测,局部代谢感受器的持续刺激极有可能在这类患者中发生,并参与其自主神经功能紊乱的形成过程。
· 2.4 肺牵张感受器·
肺牵张感受器(PSRs)是通过肺迷走神经传入纤维介导肺充气反射的关键结构,被认为可能参与COPD患者交感神经活性增强的过程。
肺牵张感受器主要分为两类:
1)缓慢适应性受体(slowly adapting receptors, SARs):持续性反应,反映肺的膨胀程度;
2)快速适应性受体(rapidly adapting receptors, RARs):瞬时反应,对肺容积的短暂变化敏感
在健康个体中,它还可能调控全身血管张力与心脏自主神经功能,其介导的经典生理反射为Hering–Breuer 反射(HBR)— 正常呼吸时,肺组织充分扩张会激活肺牵张感受器,进而抑制吸气、启动呼气,并降低副交感神经输出,维持呼吸节律稳定,这部分内容在公众号往期文章中已有整理→第134期 呼吸的神经反射调节与化学调节
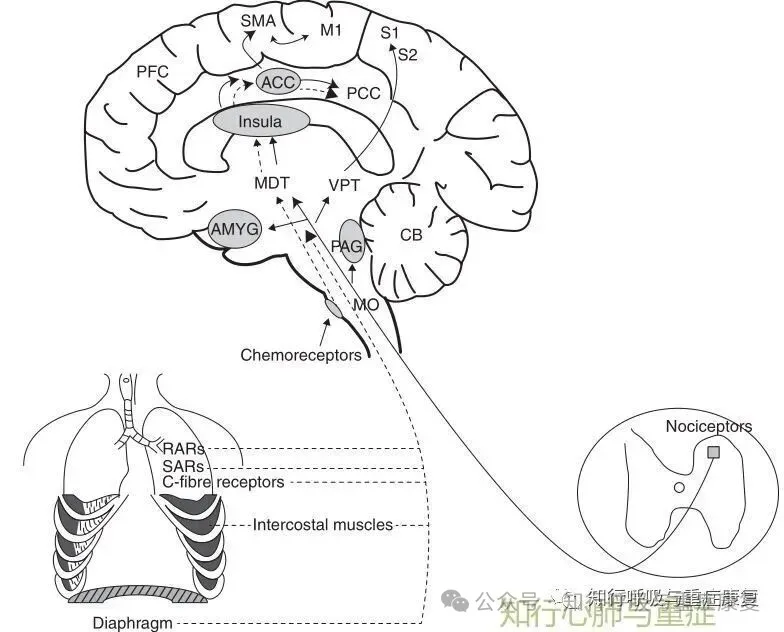
在COPD患者中,长期肺过度充气可能导致SAR纤维持续处于激活状态,从而对其他刺激的反应性下降。从而导致机械敏感性传入神经活动被严重改变,Hering–Breuer反射减弱,最终可能导致迷走神经活动模式异常,并参与COPD患者自主神经功能紊乱的形成。
·三、慢阻肺患者自主神经功能紊乱机制 ·
如前文所述,COPD不仅损害呼吸系统,也广泛影响心血管与神经系统。由于这些系统共享类似的中枢调控机制,一旦某一环节受损,便可能引起连锁紊乱。
· 3.1外周感受器功能下降·
目前已有越来越多的证据表明,肺过度充气会直接影响心功能与心脏舒张期充盈状态,也有学者明确观察到肺过度充气的严重程度和每搏输出量之间存在负相关关系。
进一步的研究表明,压力感受性反射敏感性可作为心肌梗死后患者预后的独立判断指标;其中,该指标低于3ms/mgHg的患者两年死亡率达 9%,远高于指标大于3ms/mgHg患者2%的死亡率。
慢阻肺患者肺过度充气会导致肺组织扩张,同时伴随胸腔内压力升高,这一过程可能会改变肺部迷走神经机械敏感性牵张感受器的敏感性与活性。
此外,肺动脉高压的存在可能会像影响心脏充盈那样,对压力感受性反射功能产生直接作用
与此同时,COPD患者慢性缺氧、炎症及肺动脉高压均可造成感受器脱敏或功能下降,进一步加剧自主神经功能紊乱

· 3.2 传入神经传导异常·
慢阻肺时迷走神经及舌咽神经传入纤维受以下因素影响:
1)缺氧与氧化应激→轴突损伤、髓鞘变性;
2)系统性炎症(如TNF-α、IL-6、IL-1β) → 神经传导障碍;
3)炎症信号入脑 → 通过血脑屏障薄弱区或信号通路影响下丘脑,激活HPA轴分泌糖皮质激素,从而抑制外周过度炎症反应。
外周炎症发生时,白细胞介素-1(IL - 1)、肿瘤坏死因子(TNF)、前列腺素 E₂(PGE₂)这些炎症介质,能通过特定途径(如血脑屏障的薄弱区域或间接信号传递)抵达下丘脑,激活并让中枢快速感知身体的炎症状态;另一方面,中枢神经元并非被动接收信号,自身也能合成 IL-1、TNF等免疫分子,这些分子不再是传统意义上的 “炎症标志物”,而是成为神经元之间传递信息的 “信使”,参与中枢神经系统内部的功能调节。当外周炎症信号激活下丘脑 - 垂体 - 肾上腺轴(HPA 轴)后,肾上腺会分泌糖皮质激素,作用于外周的炎症细胞(如巨噬细胞、淋巴细胞等),抑制其继续产生IL-1、TNF等促炎细胞因子。通过这一循环,机体能避免炎症反应过度放大,防止炎症对自身组织造成损伤,是机体自我稳定的重要保障。
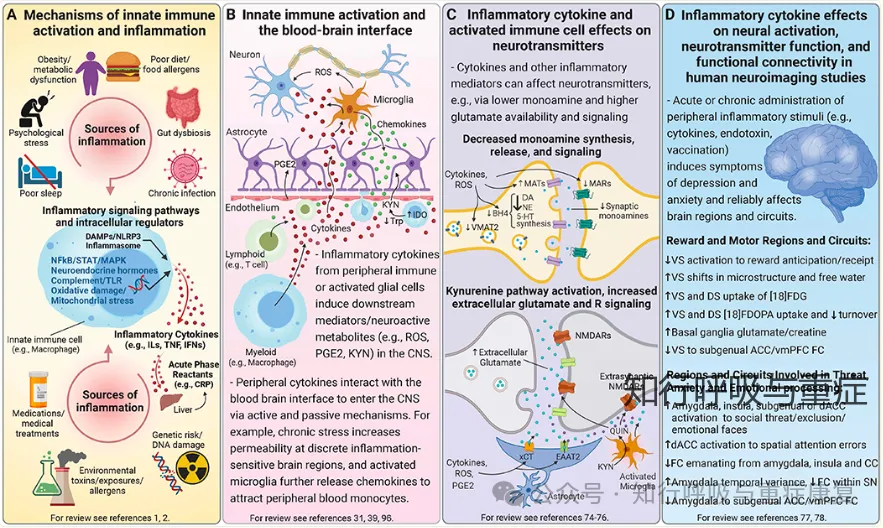
这一中枢-外周双向调控机制是机体自稳的重要保障,但在COPD长期炎症状态下可能被破坏,导致炎症反射失衡。
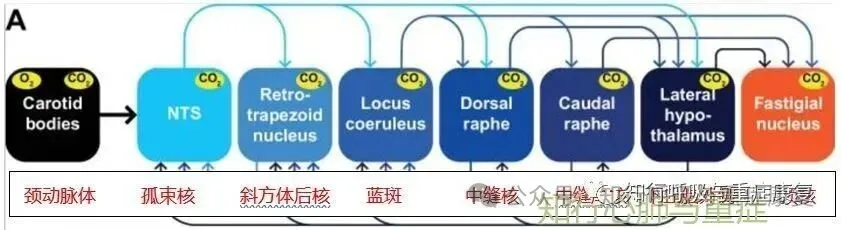
· 3.3 中枢整合中枢(延髓–下丘脑–脑干)功能抑制·
慢阻肺患者长期的慢性缺氧、二氧化碳潴留和全身慢性低度炎症两大病理状态主导,再加上神经递质紊乱、能量代谢障碍等因素的协同作用,从细胞结构、信号传递、调控网络等多个层面损伤中枢功能神经元膜兴奋性以及神经递质调控 → 自主反射“失调”。
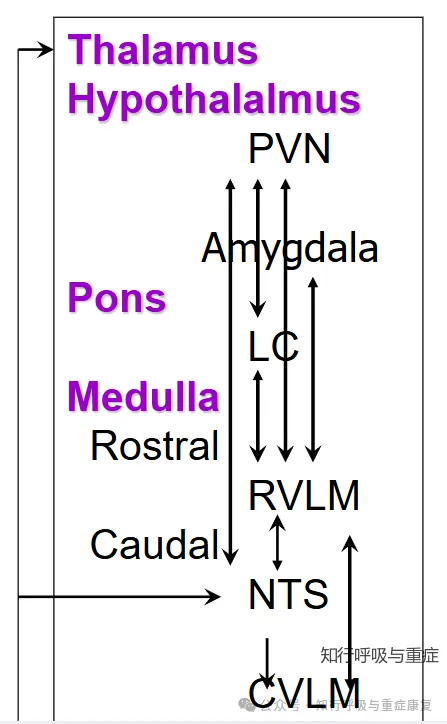
1)缺氧导致神经元能量代谢崩溃:这些中枢神经元要维持信号处理、指令发放等功能,需大量 ATP 供能,而ATP主要靠线粒体有氧呼吸生成。
2)高碳酸血症扰乱细胞内环境稳态:过多的二氧化碳会穿透神经元细胞膜进入细胞内,导致细胞内pH值下降,酸碱失衡的出现会严重干扰神经元膜上离子通道的通透性,影响钠、钾、钙等关键离子的跨膜流动,破坏动作电位的正常产生和传导,让中枢整合中枢无法精准整合外周信号,也难以发出协调的调控指令
3)以及前文提到的炎症反射通路,炎症因子侵袭中枢整合中枢,造成持续性损伤。
· 3.4 传出效应系统疲劳或重塑·
COPD患者气道及肺部存在长期炎症,炎症细胞会持续释放IL-6、TNF-α 等促炎因子,长期作用下导致交感神经兴奋性异常增高;同时,当慢性低度炎症持续存在时,这种调控机制会逐渐失衡,会长期抑制迷走神经活性,最终形成 “交感亢进、迷走低活性” 的失衡状态。
从而出现心率变异性降低,以及运动不耐受、体位性低血压等问题。
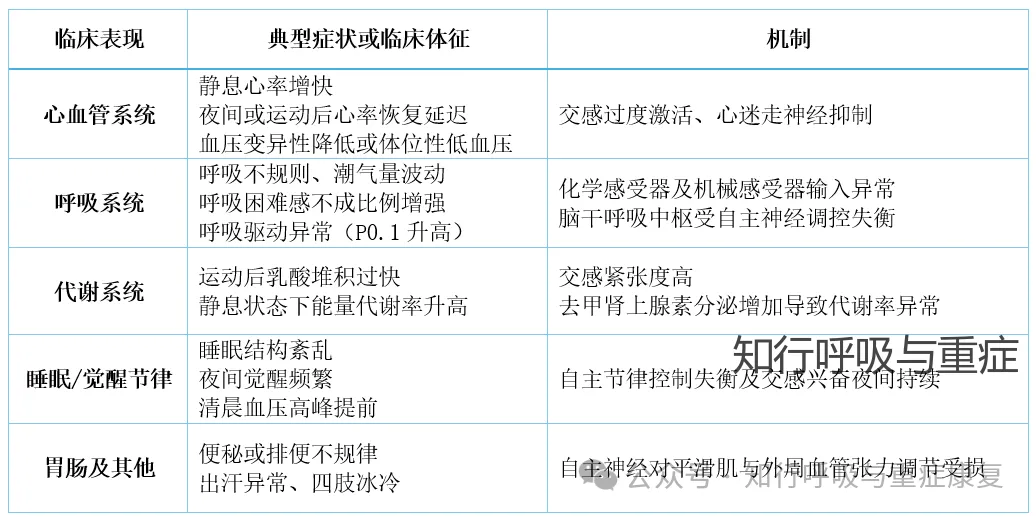
· 慢阻肺患者自主神经功能紊乱的临床表现 ·
COPD患者的自主神经功能紊乱主要体现为交感神经活性亢进、迷走神经功能减退或二者失衡。常见具体表现如下:

在客观检查可以观察到:心率变异性(HRV)低;心率恢复(HRR)慢;Valsalva试验以及深呼吸试验时心率反应幅度减小;皮肤交感反应(SSR)或皮肤电导反应(EDA)波幅降低或潜伏期延长。
在往期公众号也有整理过体位性低血压与体位性心动过速等内容→第215期 体位变化对心血管系统的影响:从生理机制到临床实践
· 总结 ·
综上所述,在COPD患者中,自主神经功能障碍并非单一机制,而是感受器功能下降、神经传导受损、中枢整合异常与传出反应失衡的多重结果。
自主神经功能障碍不仅会造成COPD患者运动耐力下降,还提升心血管事件发生风险,进而导致不良预后;
而呼吸康复中有氧运动训练、呼吸肌训练、HRV生物反馈以及吸氧等方式,能够在一定程度上帮助恢复交感神经与副交感神经的平衡,因篇幅原因,自主神经功能障碍的评估与呼吸康复策略有机会再整理。
· 参考文献 ·
[1]van Gestel AJ, Steier J. Autonomic dysfunction in patients with chronic obstructive pulmonary disease (COPD). J Thorac Dis. 2010;2(4):215-222. doi:10.3978/j.issn.2072-1439.2010.02.04.5
[2]Mayr AK, Wieser V, Funk GC, et al. Impaired Spontaneous Baroreceptor Reflex Sensitivity in Patients With COPD Compared to Healthy Controls: The Role of Lung Hyperinflation. Front Med (Lausanne). 2022;8:791410. Published 2022 Jan 3. doi:10.3389/fmed.2021.791410
[3]Goldsmith DR, Bekhbat M, Mehta ND, Felger JC. Inflammation-Related Functional and Structural Dysconnectivity as a Pathway to Psychopathology. Biol Psychiatry. 2023;93(5):405-418. doi:10.1016/j.biopsych.2022.11.003
[4]Tracey KJ. The inflammatory reflex. Nature. 2002;420(6917):853-859. doi:10.1038/nature01321
[5]Wells R, Tonkin A. Clinical approach to autonomic dysfunction. Intern Med J. 2016;46(10):1134-1139. doi:10.1111/imj.13216