核酸适体作为一类能高特异性、高亲和力结合靶标的 “化学抗体”,不仅可人工合成、易修饰、稳定性强,还能识别从小分子到细胞的各类目标。当它与电化学技术结合,便诞生了电化学适体传感器 —— 这类传感器兼具抗干扰强、设备简单、成本低、灵敏度高、易小型化的优势,在临床诊断、食品安全、环境监测等领域展现出巨大潜力。本文结合最新研究进展,系统拆解其核心应用与技术亮点,带你看懂这项 “精准检测黑科技”。
一、核心逻辑:核酸适体 + 电化学,让 “识别信号” 变 “电信号”电化学适体传感器的工作原理并不复杂,核心是 “靶向识别 + 信号转换” 的双重逻辑:
先将核酸适体固定在电极表面,作为 “特异性识别探针”;
当样品中存在目标靶标(如小分子、蛋白质、细菌)时,核酸适体会与之特异性结合,引发自身构象变化(如折叠、舒展);
这种构象变化会改变电极表面的电荷转移效率,或影响电活性探针与电极的距离,最终转化为可量化的电流、阻抗或电位信号;
通过检测信号强度,就能精准判断靶标的存在与否及浓度高低。
而它的核心优势,正是核酸适体与电化学技术的 “强强联合”:核酸适体解决了 “识别精准性” 问题,电化学技术解决了 “检测便捷性” 问题,两者结合既保证了检测的高特异性,又实现了设备便携、成本低廉的实用需求。
二、五大核心应用场景:从分子到细胞,覆盖全维度检测1. 小分子化合物检测:捕捉微量隐患,守护多领域安全氨基酸、ATP、抗生素、黄曲霉毒素、TNT 等小分子的检测,关系到临床诊断、食品安全、环境监测等多个领域。电化学适体传感器通过两种核心思路实现精准检测:
免标记检测:利用核酸适体与靶标结合后的构象变化,增大电极表面空间位阻,阻碍电荷转移,通过阻抗或电流变化定量分析。比如检测黄曲霉毒素 B1 的传感器,检测下限低至 1.82 pg/mL,能精准捕捉食品中的微量毒素;
标记电活性探针:在核酸适体远端修饰二茂铁、亚甲基蓝等电活性物质,结合靶标后探针与电极距离改变,引发电流变化,实现对 ATP、可卡因等的高选择性检测;
信号放大优化:为提升灵敏度,可借助纳米材料、酶促反应或核酸扩增技术(如催化发卡组装)放大信号。例如通过核酸外切酶 I 辅助的目标循环,将黄曲霉毒素 B1 的检测下限降至 0.032 pg/mL,满足痕量检测需求。
2. 蛋白质检测:精准捕捉生物标志物,助力疾病早诊蛋白质作为生命活动的核心载体,其表达异常是疾病的重要信号。电化学适体传感器针对蛋白质检测,形成了多套高效方案:
基础检测模式:阻抗型传感器可检测血小板衍生生长因子 BB、凝血酶等,伏安型传感器借助末端标记的电活性探针,实现对恶性疟原虫蛋白等的高选择性检测,检测下限最低可达 30 fmol/L;
传统信号放大:通过辣根过氧化物酶(HRP)、金属有机框架(MOFs)、金属纳米粒子等增强信号,比如在电极表面引入负载大量 HRP 的金纳米粒子,让凝血酶检测灵敏度大幅提升;
创新信号放大:利用生物体内蛋白质多为糖蛋白的特性,借助聚糖链上的活性位点,直接标记大量电活性探针(如二茂铁),无需额外放大策略即可实现高灵敏检测。例如针对肿瘤标志物 CA15-3 的比率型传感器,检测下限低至 0.021 U/mL;若进一步结合聚合反应在聚糖链上接枝探针聚合物,还能将甲胎蛋白(AFP)的检测下限降至 0.32 pg/mL,为癌症早诊提供有力支持。
3. 外泌体检测:解锁 “微型囊泡” 中的疾病密码外泌体作为细胞分泌的微型囊泡,携带母体细胞的生物活性物质,是疾病诊断的重要 “信使”。电化学适体传感器通过识别外泌体表面蛋白质实现检测:
基础定量:借助核酸适体对上皮细胞粘附分子(EpCAM)等蛋白的识别,构建伏安型传感器,快速定量肝癌细胞外泌体,检测下限低至 2.09×10⁴个 /mL;
信号放大:通过引入银纳米粒子、负载电活性探针的金纳米粒子等放大信号,将检测下限进一步降至 17 个 /μL;
选择性优化:由于单一蛋白识别易产生假阳性,可采用 “双适体策略”—— 一种适体捕获外泌体,另一种识别其表面另一类蛋白并引入信号探针,大幅提升检测特异性。
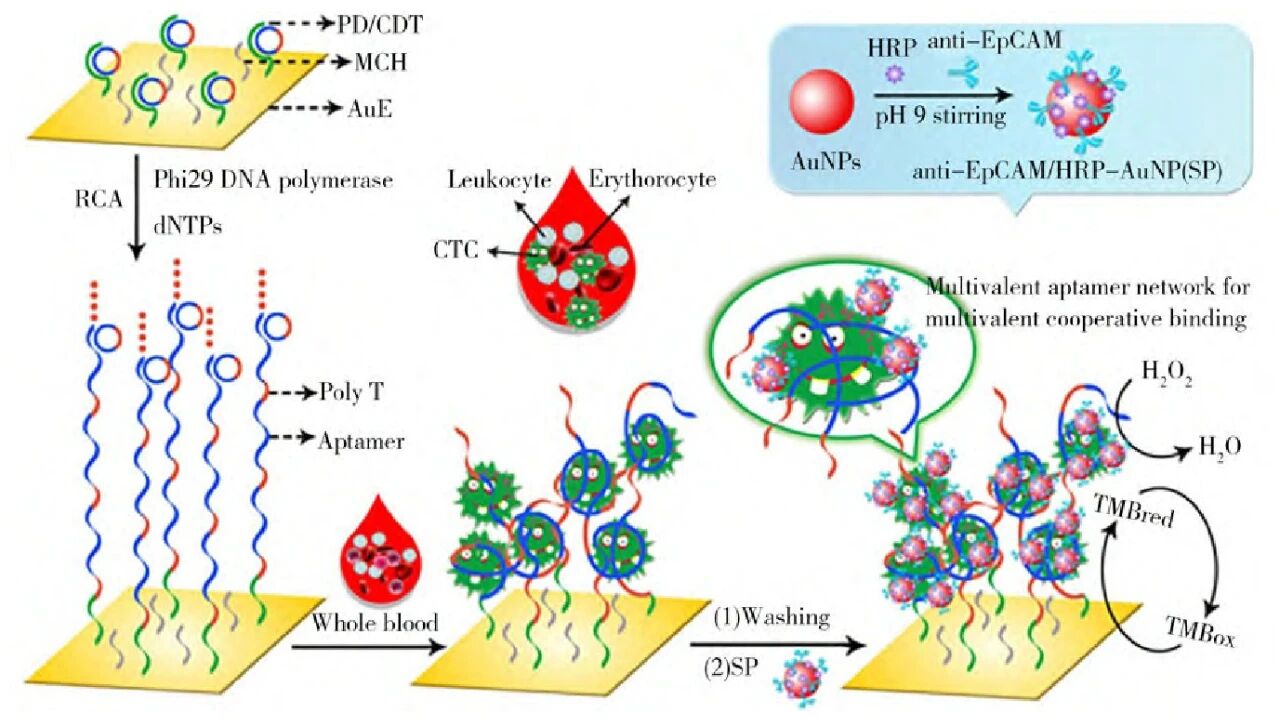
4. 循环肿瘤细胞(CTCs)检测:捕捉 “循环中的癌细胞”,助力癌症监测CTCs 作为外周血中的肿瘤细胞,是肿瘤转移和疗效评估的关键标志物。电化学适体传感器针对 CTCs 检测,重点突破 “特异性” 和 “灵敏度”:
基础捕获与检测:将 EpCAM 核酸适体固定在电极表面,通过阻抗谱分析捕获的 CTCs 浓度,检测下限可达 10 个 /mL;
高灵敏放大:引入负载 HRP 的金纳米粒子,借助生物催化放大信号,将检测下限降至 25 个 /mL;更有通过滚环扩增产生 G - 四链体结构,结合血红素形成类 HRP 复合物,实现单个 /mL 级别的超灵敏检测;
特异性提升:采用多种核酸适体协同识别 CTCs 表面不同蛋白质,避免单一蛋白识别导致的误判,让检测更精准。
5. 病原微生物检测:快速锁定病原体,守护公共安全细菌、病毒等病原微生物的快速检测,对传染病防控、食品安全至关重要。电化学适体传感器凭借核酸适体的稳定性优势,构建了高效检测体系:
基础检测:电位型传感器可快速检测伤寒沙门氏菌、李斯特菌等,检测下限低至 0.2 CFU/mL;阻抗型传感器能识别 H1N1 病毒、新冠病毒(SARS-CoV-2)等,其中新冠病毒检测下限可达 1000 个 /mL;
高灵敏优化:通过引入银纳米粒子溶出分析、HRP 生物催化等策略放大信号,将金黄色葡萄球菌的检测下限降至 1.0 CFU/mL,满足痕量病原体筛查需求。
三、挑战与展望:从实验室走向实际应用的关键突破尽管电化学适体传感器优势显著,但目前仍处于实验室验证阶段,商业化应用面临多重挑战:
实际样品干扰:血清、食品等复杂样品中,靶标浓度低且干扰组分多,对传感器的灵敏度和选择性提出更高要求;
稳定性与重现性:核酸适体结构易受环境影响,传感界面的非特异性吸附可能导致假阳性,检测结果的一致性有待提升;
技术平衡难题:阻抗型、电位型传感器操作简便但灵敏度不足,信号放大策略虽能提升灵敏度,却可能增加操作复杂度和成本。
未来,随着技术的不断优化,电化学适体传感器将朝着这些方向发展:
微型化与自动化:结合移动电子设备、物联网技术,开发便携式传感器,满足即时检验(POCT)需求;
跨技术融合:与微流控技术结合优化样品前处理,减少干扰;与人工智能、大数据结合,提升信号分析的精准度;
功能拓展:利用靶标自身聚糖链等天然结构优化信号放大,兼顾简便性与灵敏度,推动技术从实验室走向临床诊断、食品安全、环境监测等实际场景。
总结:精准检测领域的 “高效工具” 正在崛起